Задача 10.1. Используя термохимическое уравнение: 2Н2 (г) + O2 (г) = 2Н2О (г) + 484 кДж, определите массу образовавшейся воды, если выделилось 1479 кДж энергии.
Решение. Записываем уравнение реакции в виде:
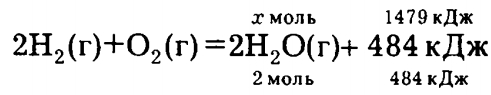
Имеем
x = (2 моль • 1479 кДж) / (484 кДж) = 6,11 моль.
Откуда
m(Н2О) = v • М = 6,11 моль • 18 г/моль = 110 г
Если в условии задачи не указано количество реагирующего вещества, а сообщается лишь об изменении некоторой величины (массы или объема), относящейся, как правило, к смеси веществ, то удобно вводить в уравнение реакции дополнительный член, соответствующий этому изменению.
Задача 10.2. К смеси этана и ацетилена объемом 10 л (н.у.) добавили 10 л (н.у.) водорода. Смесь пропустили над нагретым платиновым катализатором. После приведения продуктов реакции к исходным условиям объем смеси стал равен 16 л. Определите массовую долю ацетилена в смеси.
Решение. Водород реагирует с ацетиленом, но не с этаном.
С2Н6 + Н22 ≠
С2Н2 + 2Н2 → С2Н6
При этом объем системы уменьшается на
ΔV = 10 + 10 — 16 = 4 л.
Уменьшение объема связано с тем, что объем продукта (С2Н6) меньше объема реагентов (С2Н2 и Н2).
Запишем уравнение реакции, введя выражение ΔV.
Если в реакцию вступят 1 л С2Н2 и 2л Н2, а образуется 1 л С2Н6, то
ΔV = 1 + 2 — 1 = 2 л.
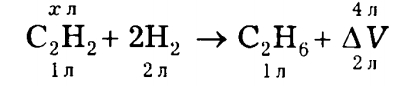
Из уравнения видно, что
V(С2Н2) = х = 2 л.
Тогда
V(С2Н6) = (10 — х) = 8 л.
Из выражением
m / М = V / VM
имеем
m = М • V / VM
m(С2Н2) = М • V / VM = (26 г/моль • 2л) / (22,4 л/моль) = 2,32 г,
m(С2Н6) = М • V / VM,
m(смеси) = m(С2Н2) + m(С2Н6) = 2,32 г + 10,71 г = 13,03 г,
w(С2Н2) = m(С2Н2) / m(смеси) = 2,32 г / 13,03 г = 0,18.
Задача 10.3. Железную пластинку массой 52,8 г поместили в раствор сульфата меди (II). Определите массу растворившегося железа, если масса пластинки стала равной 54,4 г.
Решение. Изменение массы пластинки равно:
Δm = 54,4 — 52,8 = 1,6 г.
Запишем уравнение реакции. Видно, что если из пластинки растворится 56 г железа, то на пластинку будет осаждено 64 г меди и пластинка станет тяжелее на 8 г:
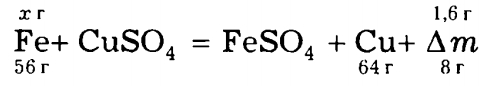
Видно, что
m(Fe) = х = 56 г • 1,6 г / 8 г = 11,2 г.
Задача 10.4. В 100 г раствора, содержащего смесь хлороводородной и азотной кислот, растворяется максимум 24,0 г оксида меди(II). После упаривания раствора и прокаливания остатка его масса составляет 29,5 г. Напишите уравнения происходящих реакций и определите массовую долю хлороводородной кислоты в исходном растворе.
Решение. Напишем уравнения реакций:
СuО + 2НCl = СuСl2 + Н2O (1)
СuО + 2НNO3 = Сu(NO3)2 + Н2O (2)
2Сu(NO3)2 = 2СuО + 4NO2 + O2 (3)
Видно, что увеличение массы с 24,0 г до 29,5 г связано только с первой реакцией, ведь оксид меди, растворенный в азотной кислоте по реакции (2), в ходе реакции (3) вновь превратился в оксид меди такой же массы. Если в ходе реакции (1) прореагирует 1 моль СuО массой 80 г и образуется 1 моль СuСl2 массой 135 г, то масса увеличится на 55 г. Учитывая, что масса 2 моль НСl равна 73 г, напишем уравнение (1) еще раз, добавив выражение Δm.
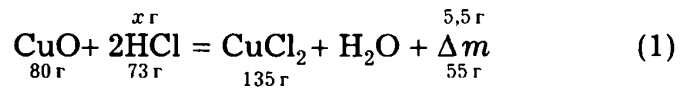
Видно, что
m(НСl) = х = 73 г • 5,5 г / 55 г = 7,3 г.
Находим массовую долю кислоты:
w(НСl) = m(НСl) / mр-ра =
= 7,3 г / 100 г = 0,073.
[]